ヒトのゲノム構造の解析

ヒトの遺伝子は、その総数が5〜10万と見積もられ、22本の常染色体と2本の性染色体上に位置しています。種々の生命現象にかかわる遺伝情報はこれらですべてまかなわれていることになります。1980年代半ばごろ、DNA 及びゲノム解析技術の著しい進展があり、30億塩基対といわれるヒトゲノムの全塩基配列の決定というとてつもない課題も、近年では、だいぶ現実味をおびてきました。各国ともこのプロジェクトに強いサポートを与えたことから、当初の予想よりはるかに早いスピードで解析が進んでいます。21世紀初頭には全塩基配列の決定を終わらせようというプログラムのもとで計画が進行しています。
[ゲノムの物理地図作製]
構造解析の極局の課題は、全ての遺伝子をカタログ化し、各種の疾患の遺伝的な基盤を明かにし、ゲノム構築の原理を明らかにすることがあげられます。このためまず物理地図を作製し、それを基に塩基配列を決め、遺伝子を同定していくという手法が必要です。現在多くの研究者がこれらの問題に取り組んでいます。1990年代に入っても、技術の革新は目ざましい勢いで進んでいます。物理地図の作製は、YACクローンをSTSというマーカーでつないでいく方法が、現在では世界的な潮流となっています。STSマーカーを用い、PCR反応で産物が出来るか出来ないかがこの物理地図づくりの原理で、判定が明確であることから、ロボット等もふんだんに導入され、既に15,000あまりのマーカーが全染色体上に配座されています。これらの情報は物理地図作製の大きな推進力となっているのです。しかしながらYACクローン固有の欠点、遺伝子密度の高いゲノム領域はクローン化出来ない等の問題も指摘されるようになり、別のアプローチも欠かせないことが示されつつあります。BACやP1といったもっと安定なクローンを用いての物理地図づくりへの転換が急速に進められています。物理地図づくりは、このような理由から、かなりの遅滞があることが予想されるが着実に問題点を解析しながら進められています。
[ゲノムの塩基配列決定]
塩基配列の決定は、自動シークエンサーを用い、スケールメリットを生かした大規模シークエンシングの時代に既に入っています。自動化等を中心にスピードアップは更に進むものと思われます。
[疾患遺伝子をつきとめる]
私たちのゲノムにはがん、糖尿病その他、様々な病気に関係する遺伝子が存在しています。これらの疾患関連遺伝子の解析は、染色体上の位置情報をもとに、ポジショナルクローニングという手法によってつきとめることができます。ゲノム情報はこれらの解析に不可欠で、その拡充により、近い将来には数千ともいわれる疾病原因遺伝子の多くは解明されるでしょう。そして診断や治療方針の決定への応用のみならず、予防や治療にも重要な知見をもたらし社会に貢献することが予想されます。
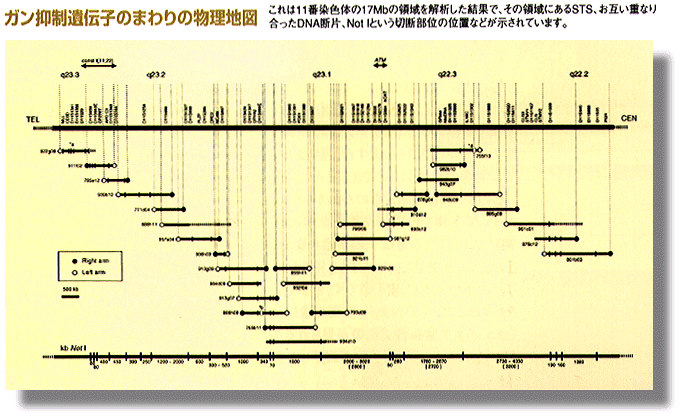
また高次な生命現象、発生や細胞の分化、さらには神経活動なども遺伝情報に支配されているところが多いはずで、これらの解明へも大きな寄与をもたらすはずです。図には、ゲノムの構造解析の流れと日本の研究成果の一部であるガン抑制遺伝子のまわりの物理地図を示しました。すでに日本の研究はこの分野でも世界に大きく貢献しています。
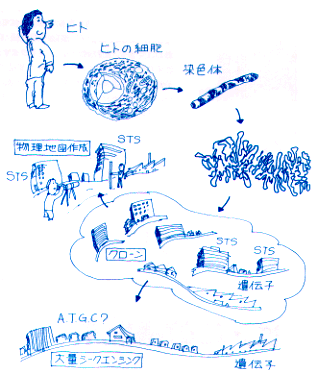
物理地図・STS・シークエンス
ゲノム構造解析について説明するのにどうしても不可欠な言葉に、物理地図、STS、シークエンスなどがあります。図を見て下さい。細胞の核にある染色体を切断すると多くの断片が得られます。それぞれの断片はYAC、BAC、P1などのベクターと結合してクローンとなります。断片はもちろんDNAの塩基配列でできていますが、その中にはユニークな塩基配列である
STS
や機能に対応する遺伝子が含まれています。STS同士やSTSと遺伝子の距離を測って、断片の並び方を決めることによって
物理地図
ができます。これは病気の遺伝子を見つけるのに大変役に立ちます。また、クローンの大規模な
シークエンス
の解析を行い、生物の全塩基配列も明らかになります。
この図ではゲノムの構造解析の意味をわかりやすく示すために、DNAの塩基配列を道路とそれに沿った建物でモデル化してあります。ビルがSTS、工場が遺伝子です。